Wie Pilze im Wald fung(h)ieren
Ein Waldökosystem ohne Pilze ist unvorstellbar, da sie im Wald viele wichtige Funktionen erfüllen. Einige, sogenannte saprophyte Pilzarten zersetzen und ernähren sich von organischem Material wie Holz und Blätter und sind Nahrung und Lebensraum für viele Tiere und durchziehen (Tot-)Holz und Waldböden mit ihrem Myzel. Andere Arten, die Mykorrhizapilze, leben in Symbiose mit Bäumen, deren Wasser- und Nährstoffzunahme sie erleichtern. Die Pilze wiederum bekommen von den Bäumen Stoffe, die ohne Fotosynthese nicht herstellbar sind [1].
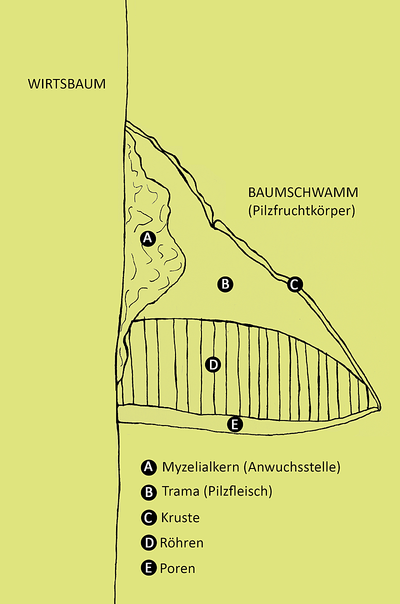
Zu den saprophyten Pilzen gehören der Rotrandige Baumschwamm (Fomitopsis pinicola) und der Echte Zunderschwamm (Fomes fomentarius). Diese Pilze bilden Fruchtkörper aus (auch Porlinge genannt), die zum Teil Jahrzehnte lang bestehen bleiben und für uns Menschen meist den auffälligsten und sichtbaren Teil der Pilze bilden. Tatsächlich sind die mehrjährigen Porlinge nur ein kleiner Teil des gesamten Pilzes: Der Rest, ein großes Geflecht aus Pilzfäden, das sogenannte Myzel, durchzieht oft von uns unbemerkt das Holz der von den Pilzen befallenen Bäume. Obwohl die Porlinge nur ein kleiner Teil der Pilze sind, erfüllen sie eine wichtige Rolle bei deren Fortpflanzung, indem sie Sporen bilden. Zugleich sind sie Mikrohabitat (= Lebensraum und Nahrungsquelle) für eine Vielzahl waldbewohnender Kleintiere, die zum Beispiel in den Poren leben oder sich von anderen Teilen des Fruchtkörpers ernähren (Abb. 1). Zwei der Tierarten, die ohne diese mehrjährigen Porlinge keinen Lebensraum hätten, sind der Gelbbindige Schwarzkäfer (Diaperis boleti) und der Kurzflügler Gyrophaena boleti.
Rotrandiger Baumschwamm – Ein Pilz wie ein Cocktail
Fomitopsis pinicola – Was klingt wie ein sommerlicher Cocktail, ist in Wirklichkeit der wissenschaftliche Name des Rotrandigen Baumschwamms, ein mehrjähriger, holzzersetzender Pilz. In unseren Breiten bevorzugt er Fichten (Picea abies) als Wirt, kann aber auch an Laubholz gefunden werden [2-5]. Der Fruchtkörper des Rotrandigen Baumschwamms wird bis zu 30 cm groß [5, 6], wobei das Wachstum des Pilzfruchtkörpers durch verschiedene Faktoren wie zum Beispiel Feuchtigkeit, Temperatur, Nährstoffverfügbarkeit und Licht beeinflusst wird [7]. Charakteristisch für diesen Porling ist ein heller Bereich, die Zuwachszone, der sich im Lauf der Zeit über orangegelb und rot zu grau bis schwarz verfärbt und die Kruste bildet [5] (Abb. 1, Abb. 2). Am Baum verursacht der Rotrandige Baumschwamm Braunfäule. Das führt zu einer reduzierten Festigkeit des Stammes [5, 8]. Was für den Baum Zerfall bedeutet, heißt für andere Leben. Denn der Rotrandige Baumschwamm ist Lebensraum für eine bunte Mischung an Insekten und bietet ihnen einen reich gedeckten Tisch mit bester Nahrungsqualität, indem er die im Totholz verfügbaren Nährstoffe herausfiltert [2] und diese für Insekten leichter zugänglich macht. Zwei der Insekten, die sich an diesem Menü bedienen, sind der Gelbbindige Schwarzkäfer (Diaperis boleti) und der Kurzflügler Gyrophaena boleti.
Echter Zunderschwamm – ein Pilz wie aus dem Buche
Der Echte Zunderschwamm (Fomes fomentarius) besiedelt im Gegensatz zum Rotrandigen Baumschwamm vorwiegend Laubholz, wobei die Rotbuche (Fagus sylvatica) der wichtigste Wirt des Pilzes ist [9]; neben der Buche werden häufig auch Birken besiedelt, Fichten hingegen nur sehr selten [5]. Die Fruchtkörper des Echten Zunderschwamms erscheinen graubraun und leben 4-7 Jahre, wobei sie in Ausnahmefällen über 30 Jahre erreichen können und bis zu 50 cm groß werden [5].
Um sich an einem Baum anzusiedeln, ist der Echte Zunderschwamm auf lebendes Holz angewiesen. Wenn ein Baum befallen ist, arbeitet sich der Porling zunächst im Bauminneren vor und destabilisiert ihn schließlich, indem er Weißfäule verursacht [5, 6, 10]. Das klassische Bild einer Rotbuche deren Absterben durch den Echten Zunderschwamm ausgelöst wurde, ist ein mehrere Meter langer Holzstubben [10] (Abb. 3).
Was auf den ersten Blick nach Tod und Zerstörung aussehen mag, ist wie beim Rotrandigen Baumschwamm strukturreicher Lebensraum für verschiedenste Arten. Bei Untersuchungen in Norwegen wurden an den Fruchtkörpern des Echten Zunderschwamms 35-43 verschiedene Käferarten gefunden [11, 12]. Doch auch von diesem Pilz profitieren zahlreiche Insekten, nicht nur Käfer. Nach der Überwinterung sind die Nahrungsreserven dieser Insekten aufgebraucht und müssen dringend wieder gefüllt werden, wobei das reiche Sporenangebot des Echten Zunderschwamms im Frühling eine entscheidende Rolle spielt [13]. Während dieser Zeit gibt der Echte Zunderschwamm unzählige weiße Sporen in die Umgebung ab, um sich zu verbreiten [5].
Vom Winde verweht – wie kommt der Pilz an den Baum?
Etwa 10 Jahre lang leben die Pilzfruchtkörper und bilden Sporen. Betrachtet man aufmerksam die Fruchtkörper der Baumschwämme an verschiedenen Holzstrukturen, so fällt auf, dass sie immer horizontal ausgerichtet sind (Abb. 2, Abb. 3), sowohl am stehenden, als auch am liegenden Totholz. Das lässt sich damit begründen, dass die Pilze geotrop sind, also die Schwerkraft bestimmt, wie der jährliche Zuwachs stattfindet: immer eine neue horizontale Schicht [5, 7]. Das Licht spielt bei der Ausrichtung nicht unbedingt eine Rolle [7]. Es gibt einen guten Grund für den Fruchtkörper sich immer so auszurichten, denn in dieser horizontalen Schicht werden die Sporen gebildet. Wenn die Sporen nach unten aus dem Pilz fallen und durch den Wind getragen in ihre Umgebung ausströmen, ist das eine Möglichkeit zur ungeschlechtlichen Fortpflanzung [14]. Dabei können die Sporen bereits den lebenden Baum, zum Beispiel in einem Aststummel besiedeln, werden aber oftmals erst nach dem Absterben des Baumes aktiv [8]. Auf einem abgestorbenen Baum sind dank der langen Lebensdauer der Pilze verschiedene Altersstadien von Pilzfruchtkörpern anzutreffen [2]. Das ist gut für die Insektenvielfalt, denn verschiedene Insekten sind auf verschiedene Lebensstadien der Pilze angewiesen [2].
Entscheidend ist nämlich, dass geeignete Wirtsbäume über die gesamte Lebensdauer der Pilze zur Verfügung stehen, um die mit den Pilzen und dem daraus entstehenden Totholz verbundenen Arten zu fördern. Einen wichtigen Beitrag dazu leisten Konzepte wie das Alt- und Totholzkonzept, dass seit 2010 in Baden-Württemberg im Staatswald verbindlich umgesetzt wird. Dabei werden in Wirtschaftswäldern Habitatbaumgruppen (ca. 12 Bäume) und Waldrefugien (im Idealfall 1-3 ha Wald) ausgewiesen, in denen keine Bewirtschaftung und Nutzung mehr stattfindet [15]. Auf diese Weise sich selbst überlassen, entstehen Flächen mit erhöhter Strukturvielfalt. Es reichert sich Totholz in verschiedenen Zersetzungsstadien an und bietet optimalen Lebensraum für eine Vielfalt an Pilz-, Tier- und Pflanzenarten.
Kopf voraus ins Haus – ein Kurzflügler im lebenden Porling
Der Großteil der Insekten scheint die Fruchtkörper der Baumschwämme zu besiedeln, wenn diese absterben und noch ein paar Jahre danach [2]. Nicht so der Kurzflügler Gyrophaena boleti, der die lebenden Pilzfruchtkörper der beiden oben vorgestellten Baumschwämme mit einem Mindestwassergehalt von 30-40 % bewohnt [16, 17]. Die Pilzfruchtkörper, die den Wohnraum für diesen Kurzflügler darstellen, finden sich wie im Flug. Und das im wörtlichen Sinne, denn neue Pilzfruchtkörper werden während dem Fliegen über den Geruchssinn ausfindig gemacht [2]. Ist ein Pilz entdeckt, steht der zahlreichen Besiedlung nichts mehr im Weg.
Im Sommer ist dieserKurzflügler, dessen adulte Individuen nur 0,7-1,3 mm lang sind, häufig mit bis zu 400 Individuen an der Unterseite der Pilzfruchtkörperanzutreffen [17, 18]. Das höchste Aufkommen von G. boleti ist im Mai, wobei die Adulten von Mai bis September aktiv sind [18].
Die schlanken Larven leben im Hymenium (= Porenschicht) der Pilzfruchtkörper [18] (Abb. 1-E). Dabei gehen die Larven immer mit dem Kopf voraus in die engen Poren und kommen nur für den Umzug in eine andere Pore, die 10-15 mm, beziehungsweise 1-4 Poren weiter liegt, kurz an die Oberfläche [17, 18]. In den Poren ernähren sie sich von den Sporen [16, 17].
Für die erwachsenen Insekten ist es vorbei mit der Gemütlichkeit der Poren. Denn sie gelangen nur noch mit dem Kopf in die schmalen Poren, indem sie vertikal in das Hymenium beißen [17, 18]. Sie ernähren sich vom lebenden Gewebe der Fruchtkörperoberfläche (Abb. 1-C) und verstecken sich unter dem Fruchtkörper, wenn sie nicht auf dem Hymenium zu finden sind [18]. Auch zum Überwintern nutzen diese kleinen Insekten den Schutz des Pilzfruchtkörpersr [18].
Wie viel Leben steckt im Tod? – Abgestorbene Porlinge als Lebensraum
Im Gegensatz zum Kurzflügler G. boleti lebt der Gelbbindige Schwarzkäfer (Diaperis boleti) hauptsächlich in den toten Fruchtkörpern von Baumschwämmen [19] (Abb. 4). Der Gelbbindige Schwarzkäfer ist ein pilzfressender, saproxylischer, also ein von Alt- und Totholz abhängiger Käfer [20]. Von Palm [21] wurde er ausschließlich in beziehungsweise an Pilzen, pilziger Rinde oder pilzigem Holz gefunden. Die adulten Käfer sind meist auf dem Hymenium von Pilzfruchtkörpern zu finden [22]. Oft leben sie in besonders trockenen Fruchtkörpern, die von anderen Käfern gemieden werden [23]. Wer in diesen Pilzen wohnen möchte, muss mit harten, zähen Bedingungen rechnen. Entsprechend sind die Larven mit einem großen Kopf und starkem Unterkiefer ausgerüstet, damit sie in das reife Pilzgewebe, das Trama (Abb. 1-B), der Pilzfruchtkörper gelangen können [22]. Im Inneren des Pilzes legen sie zylindrische Galerien an, die später von den adulten Käfern der nächsten Generation bewohnt werden [22].
Der gesamte Lebenszyklus dauert ein Jahr: die Weibchen legen die Eier bei Sonnenschein in die Oberseite des Pilzes [24], wo Anfang Juni bis Mitte Juli die Larven schlüpfen. Die Entwicklung ist ein komplizierter Prozess: Sobald die Larven ihr Wachstum vollenden, bauen sie einen Kokon und die Metamorphose setzt ein [22]. Den Kokon bildet ein ins Pilzgewebe genagtes Loch, das mit Nagespänen abgedichtet wird, um Temperatur- und Feuchtigkeitsschwankungen zu vermeiden [24]. Mitte bis Ende September sind die meisten Adulten dieser Generation zu finden [22]. Den anschließenden Winter verbringen die Käfer in adulter Form, um im folgenden Jahr den Zyklus dieser Insekten von Neuem zu beginnen [22].
Das Ökosystem Wald, ein vielschichtiger und vielseitiger Lebensraum auch im Kleinen. In diesem Artikel wurde der Fokus auf die Lebensweisen zweier Insekten und zweier Baumschwämme gelegt, doch es gibt noch vieles mehr zu entdecken. Denn neben den hier vorgestellten Arten gibt es, wie bereits angedeutet wurde, noch viele weitere. Diese oftmals weniger bekannten Arten profitieren ebenfalls vom Alt- und Totholz verschiedener Dimensionen und Zersetzungsstadien in unseren Wäldern. Es lohnt sich also, beim nächsten Waldspaziergang einmal genauer hinzusehen.
Quellen
- Wiesner, M. Pilze sind für das Ökosystem Wald zentral. 2019 URL: https://www.waldzeit.ch/pilze/pilze-sind-fuer-das-oekosystem-wald-zentral/#Mykorrhizapilze [aufgerufen am 11.06.21].
- Jonsell, M. and G. Nordlander. Field attraction of Coleoptera to odours of the wood-decaying polypores Fomitopsis pinicola and Fomes fomentarius. in Annales Zoologici Fennici. 1995. JSTOR.
- Högberg, N., O. Holdenrieder, and J. Stenlid, Population structure of the wood decay fungus Fomitopsis pinicola. Heredity, 1999. 83(3): p. 354-360.
- Wieners, M., et al., The Rare Rolypore Antrodiella citrinella and Its Special Shenology in the Black Forest National Park (Germany). Journal of Biodiversity & Endangered Species, 2016. 4: p. 168
- Dörfelt, H. and E. Ruske, Die pileaten Porlinge Mitteleuropas: Morphologie, Anatomie, Bestimmung. 2018, Jena: Springer-Verlag. 397 S.
- Krieglsteiner, G.J. and A. Kaiser, Band 1: Allgemeiner Teil: Ständerpilze: Gallert-, Rinden-, Stachel- und Porenpilze. Die Großpilze Baden-Württembergs, ed. G.J. Krieglsteiner. Vol. 1. 2000, Stuttgart (Hohenheim): Verlag Eugen Ulmer. 634.
- Schmidt, O., Wood and tree fungi. 2006: Springer. 336 S.
- Ammann, M., Schutzwirkung abgestorbener Bäume gegen Naturgefahren. 2006: ETH Zürich. 240 S.
- Blaschke, M., C. Hahn, and W. Helfer, Die Pilzflora der Bayerischen Naturwaldreservate. LWF Wissen, 2004. 43: p. 5-30.
- Möller, G., Großhöhlen als Zentren der Biodiversität. 2006. 20 S.
- Rukke, B.A., Fungivorous beetles in basidiocarps of Fomes fomentarius respond differently to microhabitat variables. European Journal of Entomology, 2002. 99(1): p. 43-52.
- Thunes, K.H., The coleopteran fauna of Piptoporus betulinus and Fomes fomentarius (Aphyllophorales: Polyporaceae) in western Norway. Entomologica Fennica, 1994. 5(3): p. 157-168.
- Möller, D.G., Erfassung der Holzpilze in ausgewählten Untersuchungsflächen. leben.natur.vielfalt - das Bundesprogramm, o. J.: p. 60.
- Seibold, S., et al., Fungi associated with beetles dispersing from dead wood–Let's take the beetle bus! Fungal Ecology, 2019. 39: p. 100-108.
- Landesbetrieb ForstBW, Alt- und Totholzkonzept Baden-Württemberg. ForstBW Praxis. 2017, Stuttgart: Landesbetrieb ForstBW. 44 S.
- Hågvar, S., Saproxylic beetles visiting living sporocarps of Fomitopsis pinicola and Fomes fomentarius. Norwegian Journal of Entomology, 1999. 46: p. 25-32.
- Hågvar, S., Contribution to the ecology of Gyrophaena boleti (Linnaeus, 1758) (Coleoptera, Staphylinidae) breeding in the pore layer of the fungus Fomitopsis pinicola (Fr.) Karst. Journal of Entomology, 2018. 65: p. 108-114.
- Staniec, B., E. Pietrykowska-Tudruj, and K. Czepiel-Mil, Larva of Gyrophaena boleti - an obligatory saproxylic and mycophagous species associated with fomitopsis pinicola: Notes on tergal gland system and behaviour. Annales Zoologici (Warschau), 2016. 66(1): p. 83-100.
- Krasutskii, B.V., Coleoptera associated with Fomitopsis pinicola (Sw.: Fr.) Karst. (Basidiomycetes, Aphyllophorales) in the forests of the Urals and Transurals. Entomological Review, 2007. 87(7): p. 848-858.
- Oleksa, A., Weak isolation by distance in Diaperis boleti, a fungivorous saproxylic beetle. Journal of Insect Science, 2014. 14(1): p. 109.
- Palm, T., Die Holz-und Rinden-käfer der nordschwedischen Laubbäume. Meddelanden fran statens skogsforskningsinstitut, 1951. 40(2).
- Wiater, A., et al., Isolation and characterization of α‐(1→ 3)‐glucan‐degrading bacteria from the gut of Diaperis boleti feeding on Laetiporus sulphureus. Entomological Science, 2019. 22(1): p. 36-41.
- Köhler, M., Die Veränderung der Schwarzkäferfauna (Coleoptera, Tenebrionidae) im Rheinland in Abhängigkeit von Umweltveränderungen und Klimawandel. 2012. 22: p. 37-59.
- Lillig, M., Zur Zoogeographie westpaläarktischer Tenebrionidae (Insecta: Coleoptera). 2015, Universität Basel. 368 S.