Fig. 1: Femelle ( à gauche) et mâle (à droite) de drosophile du cerisier (D. suzukii) sur une mûre de ronce. Photo: lrene Bühlmann
Les espèces introduites, y compris de nombreux insectes, peuvent se propager rapidement et nuire à l'être humain et à l'environnement (Vilà & Hulme 2017). La drosophile du cerisier Drosophila suzukii (fig. 1) est une espèce de drosophile invasive originaire d'Asie de l'Est et du Sud-Est. Aujourd'hui largement répandue, elle a été détectée pour la première fois en Suisse en 2011 et s'est largement établie depuis (Cini et al. 2012). Longue d'environ 2,5 à 3,5 millimètres, elle est caractérisée par la tache noire à l'extrémités des ailes des mâles et par le puissant organe de ponte dentelé des femelles. Cet ovipositeur capable de percer l'épiderme de fruits intacts, mais aussi le taux de reproduction élevé de D. suzukii augmentent le potentiel de nuisance du ravageur. Les femelles pondent entre 100 et 400 œufs (Kirschbaum et al. 2020), et en raison de la courte durée de développement entre l'œuf et l'adulte (à 23 °C par exemple 10 à 12 jours), on peut probablement compter avec quatre à huit générations par an en Suisse (Wiman et al. 2014).
Des études récentes dans des régions boisées ont mis en évidence un nombre élevé de captures de drosophiles et donc probablement aussi des densités élevées de population (Briem et al. 2018). Cela est probablement dû au fait que la nourriture et le substrat de ponte sont disponibles de manière plus constante qu'en milieu ouvert (Poyet et al. 2015) ; de plus, les conditions climatiques (humidité relative élevée) sont également favorables la drosophile (Hamby et al. 2016).
Drosophile du cerisier et les drosophilidés indigènes
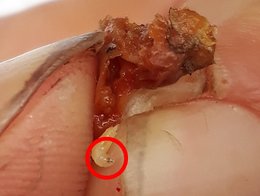
Les fruits et baies des plantes sauvages et cultivées sont utilisés par divers drosophilidés (mouches du vinaigre) et de nombreuses espèces d'autres familles d'insectes pour y pondre leurs œufs (fig. 2). En Suisse, on compte 36 espèces de drosophiles, qui s'ajoutent à 30 espèces appartenant à d'autres genres de la famille des Drosophilidae. Contrairement aux drosophiles indigènes, D. suzukii peut pondre sur des fruits intacts grâce à son ovipositeur fortement dentelé. Ses œufs sont donc plus tôt dans le fruit que ceux des autres espèces, et elle accède à une gamme plus large de substrats de ponte. Cela lui confère un avantage concurrentiel sur les espèces indigènes.
Fig. 2 : Pontes de la drosophile du cerisier Drosophila suzukii sur la ronce commune (Rubus fruticosus corylifolius agg., à gauche) et le sureau noir (Sambucus nigra, au centre). Les tubes respiratoires des œufs pendent généralement de manière bien visible hors du trou de ponte. À droite : crochet buccal noir et squelette céphalo-pharyngien de la larve sur une baie de chèvrefeuille des haies (Lonicera xylosteum). Photos: Irene Bühlmann
Les nombres de captures, réalisées grâce à des pièges appâtés au vinaigre de cidre de pomme, montrent une nette prédominance de la drosophile du cerisier exotique dans toutes les associations forestières étudiées. La proportion médiane de D. suzukii par rapport à l'ensemble des drosophilidés dans les associations forestières étudiées se situait entre 82 % et 95 % (fig. 3).
Fig. 3: Nombre de captures de drosophiles du cerisier Drosophila suzukii et de drosophiles indigènes, et proportion de D. suzukii dans les captures réalisées dans les associations forestières 26 f/g, 19a, 7a et en lisière de forêt pendant la période d'étude (160 piégeages ; 40 pièges par association forestière).
Infestation de plantes forestières
Drosophila suzukii peut affecter les fruits (à l'épiderme tendre) de nombreuses espèces végétales (Kirschbaum et al. 2020). Cependant, la présence de la drosophile en forêt, l'utilisation de plantes forestières hôtes potentielles et son impact sont insuffisamment connus. Afin de combler cette lacune, nous avons suivi l'infestation de plantes forestières par la drosophile du cerisier dans les cantons de Zoug et de Zurich, tous les 20 jours de mi-juin à mi-octobre 2020.
Sur l'ensemble des 64 lacettes, nous avons examiné plus de 12 000 fruits et baies. Nous avons ainsi pu prouver que la drosophile du cerisier pond ses œufs sur un très large éventail de plantes hôtes. Sur les 39 plantes hôtes potentielles de notre étude, les fruits de 31 espèces étaient infestés. Plus le statut prédominant de maturité des fruits sur la placette était avancé, plus ces plantes étaient infestées. Sur 19 espèces végétales, nous avons constaté une prévalence d'infestation de plus de 50 %. Les espèces les plus fortement infestées étaient la belladonne (Atropa bella-donna), la ronce commune et la ronce à feuilles de noisetier (Rubus fruticosus agg. / Rubus corylifolius agg.), la bourdaine (Frangula alnus) et le sureau noir (Sambucus nigra), ainsi que le cotonéaster divariqué, un arbrisseau exotique (Cotoneaster divaricatus, tabl. 1).
Tabl. 1 : Fréquence d’infestation des plantes hôtes potentielles dans la zone d’étude. * = Espèces regroupées de Rubus fruticosus agg. et Rubus corylifolius agg. (1) = fréquence d’infestation estimée basée sur le comptage des larves et l’éclosion des fruits, car la ponte pouvait rarement être clairement attribuée en raison de nombreuses autres traces d’alimentation.
La quantité de fruits infestés par la drosophile du cerisier est considérable. Par exemple, une prévalence de 83 % a été observée chez le sureau noir. Sur le nombre estimé de fruits de toutes les placettes étudiées, soit environ 70 000 fruits de sureau, près de 60 000 fruits étaient probablement infestés. La condition principale pour la ponte est la pénétration de l'épiderme qui protège en principe le fruit contre les influences extérieures et donc aussi contre une infestation par la drosophile du cerisier. Nous avons en effet pu confirmer que les fruits à l'épiderme plutôt dur et/ou à la chair ferme tels que le sorbier (Sorbus aucuparia) étaient peu ou pas infestés. Les fruits de végétaux tolérants à l'ombre – des plantes forestières typiques telles que les chèvrefeuilles (Lonicera) – ont un épiderme relativement tendre et sont donc particulièrement sensibles aux infestations.
Potentiel de nuisance de la drosophile du cerisier
Les larves de drosophiles se nourrissent principalement de micro-organismes (de préférence des levures, mais aussi des bactéries acétiques) qui décomposent la substance du fruit, mais aussi du tissu de fruits décomposés. Les différentes espèces de drosophiles inoculent leur substrat de ponte avec des micro-organismes qui aident à démarrer la décomposition (pourriture, Markow & O'Grady 2008). En pondant, la drosophile du cerisier détruit la protection mécanique qu'offre l'épiderme du fruit et infecte sa chair (figures 3 et 4).
Ces fruits sont alors non seulement impropres à la consommation pour les humains, mais aussi généralement moins attrayants pour les vertébrés, en particulier pour les oiseaux. On estime que le principal impact des insectes frugivores tels que D. suzukii sur une plante est indirect, à savoir la réduction de la propagation des graines (Sallabanks & Courtney 1992). En réponse à la ponte, nous avons observé des symptômes de décomposition (indentation, suintement, déformation et décoloration). La décomposition provoquée et accélérée par l'infestation modifie non seulement l'aspect visuel, mais aussi l'odeur et le goût des fruits. Les fruits infestés peuvent rapidement perdre de leur attrait, en particulier pour les oiseaux qui réagissent fortement aux stimuli visuels. Nous avons souvent observé des fruits décomposés encore présents sur les rameaux (« momies »), ce qui indique que les oiseaux évitent les fruits infestés (fig. 6).
Chez 77 % des espèces végétales, nous avons constaté une décomposition modérément à fortement accélérée due à la ponte de la drosophile du cerisier. Cette décomposition, et donc la pourriture des fruits qui se dessèchent sur la plante ou tombent au sol, réduit la fenêtre temporelle pendant laquelle des fruits mûrs sont disponibles. Cela se répercute sur d'autres animaux frugivores, qui sont d'une part des concurrents alimentaires de la drosophile, mais d'autre part jouent un rôle décisif dans la propagation des plantes et la création de nouveaux habitats pour celles-ci. L'infestation par D. suzukii n'affecte probablement pas la capacité germinative car la graine est déjà prête dans un fruit mûr. Toutefois, les graines germent alors souvent à proximité immédiate de la plante mère.
L'analyse de l'infestation des plantes forestières ainsi que les captures par piégeage dans les cantons de Zoug et de Zurich montrent une présence massive de la mouche à grande échelle. Les résultats suggèrent des conséquences écologiques majeures, à savoir une réduction de la dissémination des graines, l'éviction des espèces de drosophiles indigènes et une moindre disponibilité de nourriture pour les animaux frugivores, notamment les oiseaux. En outre, cette invasion a un impact négatif sur les services écosystémiques de la forêt : face à la drosophile du cerisier, les cueilleurs de baies populaires telles que la myrtille, le sureau noir ou la mûre sont clairement perdants. Des études complémentaires sont nécessaires pour comprendre et estimer les dommages écologiques.
Bibliographie citée
- Briem, F., Dominic, AR., Golla, B., Hoffmann, C., Englert, C., Herz, A., Vogt, H. Explorative Data Analysis of Drosophila suzukii Trap Catches from a Seven-Year Monitoring Program in Southwest Germany. Insects. 2018 Sep 24;9(4):125.
- Cini, A., Ioriatti, C., Anfora, G. (2012). A review of the invasion of Drosophila suzukii in Europe and a draft research agenda for integrated pest management. Bulletin of Insectology. 65. 149-160.
- Hamby, K.A., E. Bellamy, D., Chiu, J.C. et al. Biotic and abiotic factors impacting development, behavior, phenology, and reproductive biology of Drosophila suzukii . J Pest Sci 89, 605–619 (2016).
- Kirschbaum, Daniel & C.F., Funes & Buonocore-Biancheri, María & Suárez, Lorena & Ovruski, Sergio Marcelo. (2020). The Biology and Ecology of Drosophila suzukii (Diptera: Drosophilidae). 10.1007/978-3-030-62692-1_4.
- Markow, T.A. and O’Grady, P. (2008). Reproductive ecology of Drosophila. Functional Ecology, 22: 747-759.
- Poyet, M., Le Roux, V., Gibert, P., Meirland, A., Prévost, G., Eslin, P. et al. (2015). The Wide Potential Trophic Niche of the Asiatic Fruit Fly Drosophila suzukii: The Key of Its Invasion Success in Temperate Europe?
- Sallabanks, R., Courtney, SP. (1992). Frugivory, seed predation, and insect-vertebrate interactions. Annu Rev Entomol. 377-400.
- M. Vilà, P.E. Hulme (Eds.). (2017). Impact of Biological Invasions on Ecosystem Services Series: Invading Nature - Springer Series in Invasion Ecology, Vol. 12.
- Wiman, NG., Walton, VM., Dalton, DT., Anfora, G., Burrack, HJ., Chiu, JC. et al. (2014) Integrating Temperature-Dependent Life Table Data into a Matrix Projection Model for Drosophila suzukii Population Estimation. PLoS ONE 9(9): e106909.